# Lumière/matière
Blablabla
## Lien célérité, fréquence et longueur d'onde
Dans le domaine des **ondes électromagnétiques**, on travaille surtout avec 3 grandeurs liées par la relation : $c=\lambda \cdot \nu$ où $c$ est la célérité de l'onde ($3 \cdot 10^8 m\cdot s^{-1}$), $\lambda$ la longueur d'onde (en m) et $\nu$ la fréquence (en Hz).
---
## Énergie d'un photon ou quantum (1)
Chaque photon transporte un **quantum d'énergie** $E$ en $J$, à ce quantum est rattaché une **longueur d'onde** $\lambda$ en m, une **fréquence** $\nu$ en Hz.
On peut la calculer de deux façons :
$E = h \cdot \nu$ ou $E = h \cdot {c \over \lambda}$.
$h$ est la constante de Planck en $J \cdot s$.
----
### Énergie d'un photon ou quantum (2)
Le joule n'est pas une unité adapté pour ces calculs, on fera donc les conversions à partir d'une nouvelle unité : l'électronvolt.
$1 eV = 1,6 \cdot 10^{-19}J$
---
## Quantification (1)
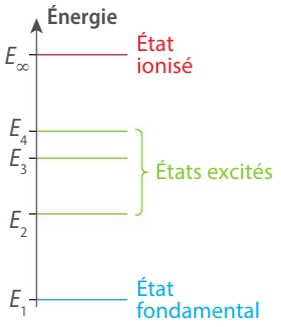
L'atome ne peut exister que dans des états bien définis caractérisé par un niveau d'énergie.
On les représente dans un **diagramme de niveaux d'énergie**.
----
### Quantification (2)
- L'**état fondamental** : c'est le niveau d'énergie le plus bas, c'est l'état stable de l'atome.
- Il sera différent d'un atome à l'autre.

----
### Quantification (3)
Les **états excités** : ce sont les autres niveaux dont l'énergie est supérieure à l'énergie de l'état fondamental.

----
### Quantification (4)
- L'**état ionisé** : c'est le niveau de plus haute énergie, il traduit la perte d'un électron l'atome est alors ionisé.
- Cet état correspond à une énergie nulle pour tous les atomes.

---
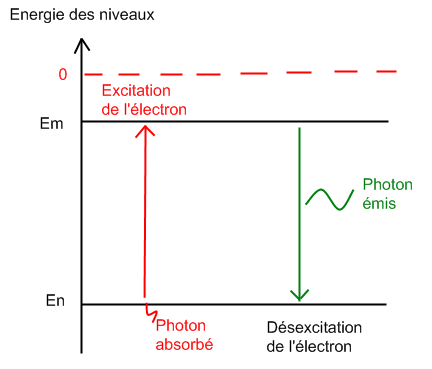
## Absorption/émission (1)
- Si un photon est absorbé, de l'énergie est gagné par l'atome (celle du quantum du photon).
- Si un photon est émis, de l'énergie est perdue par l'atome (celle du quantum du photon).
- L'absorption ou l'émission ne peut donc se faire qu'entre 2 niveaux d'énergies de l'atome.
----
### Absorption/émission (2)
On calcule l'énergie portée par le photon (émis ou reçu) par la formule : $\Delta E=|E_{final} - E_{initial}|$. Cette valeur est donc liée aux formules $E = h \cdot \nu$ ou $E = h \cdot {c \over \lambda}$.
----
### Absorption/émission (3)
On peut donc retrouver la fréquence ou la longueur d'onde du photon en connaissant la valeur de la transition :
$\lambda ={hc \over {\Delta E}}$ ou $\nu = {\Delta E \over h}$
----
### Absorption/émission (remarque)
Si l'énergie de transition est $\Delta E_{n→m}=E_{m} - E_{n}>0$, c'est une absorption.
Si l'énergie de transition est $\Delta E_{m→n}=E_{n} - E_{m}<0$, c'est une émission.

{"tags":"1ere,diapo","maths":true,"theme":"colors","slideOptions":{"theme":"white"}}