# Réaction et quantité de matière
---
### Combustion du méthane

----
CH₄ + 2 O₂ → CO₂ + 2 H₂O
1 mol de méthane réagit avec 2 mol de dioxygène pour former une mol de dioxyde de carbone et 2 mol d'eau
---
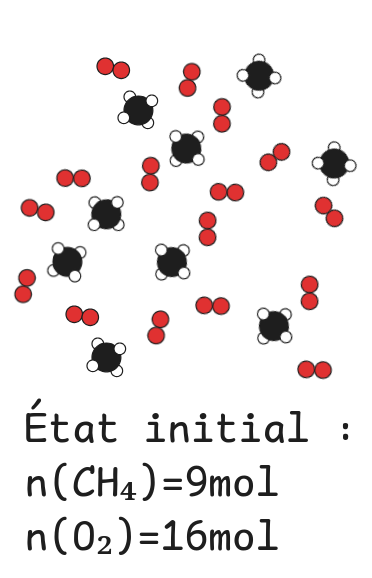
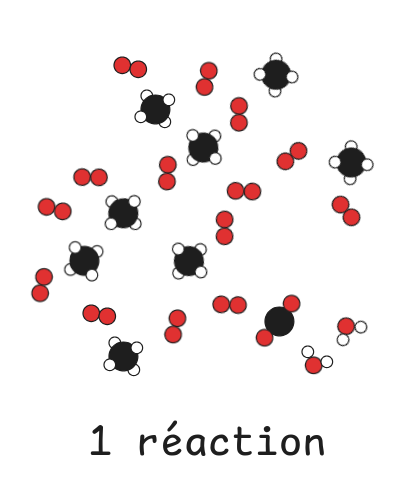
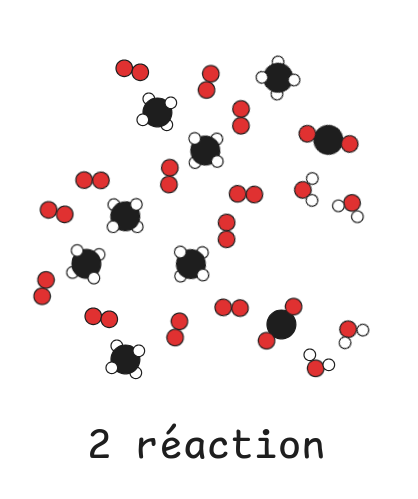
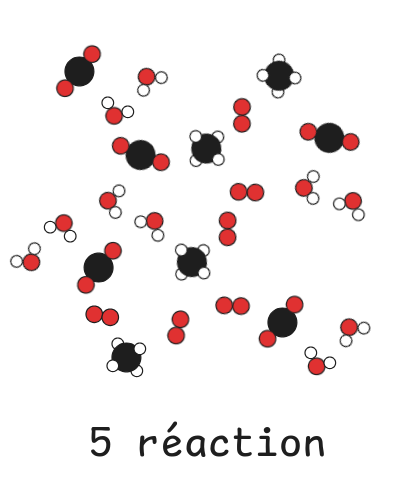
### Bilan de matière et réactif limitant
----
----
----
----
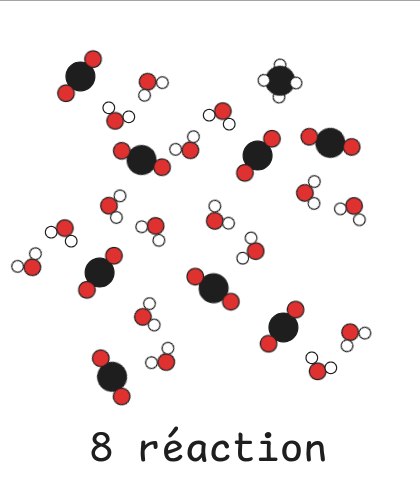
Tout le dioxygène est consommé, il est donc limitant.
---
### Conclusion
Comme ${n(CH_4) \over 1} > {n(O_2) \over 2}$, le réactif limitant est le dioxygène $O_2$.
----
Si les quantités initiales avaient été $n(CH_4)=4mol$ et $n(O_2)=9mol$, on aurait ${n(CH_4) \over 1} < {n(O_2) \over 2}$, et le réactif limitant serait le méthane $CH_4$.
----
Si les quantités initiales avaient été $n(CH_4)=4mol$ et $n(O_2)=8mol$, on aurait ${n(CH_4) \over 1} = {n(O_2) \over 2}$, le mélange serait dit **stoechiométrique** et tous les réactifs sont totalement consommés.
{"tags":"2nde,diapo,chimie","slideOptions":{"theme":"white","transition":"fade"}}