### Poudre à canon
On nomme poudre noire, ou poudre à canon, un mélange explosif de salpêtre ($\ce{KNO3}$) (du latin <i>salpetrae</i> signifiant « sel de pierre »), de soufre ($\ce{S}$) et de charbon de bois ($\ce{C}$). La plupart des historiens pensent que la poudre à canon fut inventée en Chine vers le VII<sup>e</sup> siècle.</p>
<p>L’équation de la combustion de la poudre à canon est la suivante :
$\ce{2 KNO3 + 3 C + S \rightarrow K2S + 3 CO2 + N2}$
Cette réaction est totale.
Au XIV<sup>e</sup> siècle et XV<sup>e</sup> siècle, la composition était (en masse) : 6 parties de salpêtre (75 %) pour une partie de soufre (12,5 %) et une partie de carbone sous forme de charbon de bois (12,5 %).
Cette recette était-elle optimale ?
#### Données
##### Masses molaires en g·mol<sup>-1</sup>
$M(\ce{K})=39 ; M(\ce{N}) = 14 ; M(\ce{O}) = 16 ; M(\ce{C}) = 12 ; M(\ce{S}) = 32$
##### Masse de poudre
100 g pour faciliter l'étude
### Expérience de Lavoisier
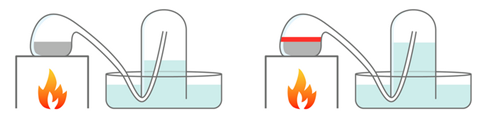
En 1775, Lavoisier a mis en évidence que l’air était un mélange de gaz et qu’il contenait du dioxygène. Il a fait bouillir 122 g de mercure Hg dans une cornue reliée à une cloche contenant 0,80 L d’air (schéma ci-dessous). Le mercure se recouvre d’une couche rouge : c’est de l’oxyde de mercure de formule HgO, il en a obtenu 2,8 g.
##### Expérience de Lavoisier, avant chauffage (à gauche) et après chauffage (à droite)
##### Données
- $M(Hg)= 200,6 g·mol^{-1}; M(O)= 16,0 g·mol^{-1}$
- Volume molaire d’un gaz dans les conditions de l’expérience : $25 L·mol^{-1}$
##### Questions
1. Écrire l’équation-bilan de la réaction chimique entre le dioxygène et le mercure.
2. Calculer la quantité de matière finale d’oxyde de mercure formé.
3. Justifiez que, d’après les résultats de l’expérience, le dioxygène est le réactif par défaut.
4. Dresser le tableau d’avancement de la réaction. La quantité initiale de $O_2$ est inconnue. Vous la noterez $n_{iO_2}$.
5. Donner la valeur de l’avancement final et en déduire la quantité initiale de $O_2$.
6. Calculer la quantité de matière d’air initialement présente dans la cloche et calculer la proportion de dioxygène présent dans l’air.
7. Calculer la masse de mercure restante en fin de réaction.